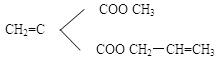|
||
| 相
关 资 讯 |
||
| 医用胶研究 我们在这里所要讨论的就是把外科手术后的伤口粘合起来,把骨骼粘合起来,把软骨同骨骼粘合起来,统而言之,就是把组织粘合起来的组织粘合剂。组织所处的环境比一般材料所处的环境更加特殊,而且组织有再生能力,这就造成开发理想粘合剂的困难。作为理想的粘合剂,除了具备一般软组织植入物所应具备的条件外,它还应该具备: (1)能使组织湿润并使组织粘合;
(2)能迅速聚合而没有过量的热及有毒产物产生;
(3)在创伤愈合时粘合剂可被吸收而不干扰正常的愈合过程。
一般说来,粘合剂本身分子极性较大,而生物体组织也是分子极性大的物质,所以当它们粘合时,就会产生较大的强度。在粘合剂中,α-氰基丙烯酸烷基酯 6.1.1 α- 氰基丙烯酸酯及聚合物的生物化学性能[1] α-氰基丙烯酸酯的致癌作用尚无定论。从用α-氰基丙烯酸甲酯对大黑鼠作皮下注射试验来看,59只大黑鼠中有8只发现产生纤维肉瘤;而普通老鼠更容易产生恶性肿瘤。但是对比老鼠大得多的哺乳动物象狗、猴等,在同样条件下则都没有出现恶性肿瘤。而在初期的临床试验中,均未发现过恶性肿瘤。但这也不能就得出在人体内一定不会产生恶性肿瘤的结论。总之,在人体内还必须作长期的考察。 关于组织响应,α-氰基丙烯酸酯涂在皮肤上,会发热并有轻度灼痛感,一周左右从表皮上脱落而无痕迹。若注入皮、骨髓、肝脏,则甲酯引起组织坏死,但随酯基碳链增长而组织响应明显下降,到己酯以上,组织响应则明显减轻。 就α-氰基丙烯酸酯在生物体内的聚合来看,与在生物体内不同,一般情况下,聚合反应速率随着酯基碳链长度的增长而下降,而在生物体内则相反,即聚合反应速率随着酯基碳链长度的增长而上升。这是由于在生物体内存在的某种催化剂在血液里有较高的浓度,而血液本身有疏水的表面和亲水的内部,当亲水的低级酯(比如α-氰基丙烯酸甲酯或乙酯)接近血液时受到它的疏水表面的排斥,使低级酯得不到浓度足够的催化剂,从而使聚合反应速率较慢;相反,若疏水表面的高级酯(比如α-氰基丙烯酸酯正戊酯、正己酯)接近血液时,因同属疏水性质,高级酯则较易被溶解,而单体在高浓度催化剂的作用下则加快了聚合作用,使聚合反应速率较快。这表明高级酯比低级酯更适宜于做组织粘合剂,因为高级酯能更快的粘合。α-氰基丙烯酸酯在生物体内的分解速率,却得到相反的结论,高级酯比低级酯要缓慢的多。 α-氰基丙烯酸酯的毒性、抗菌力和组织响应,也得到相反的结果。从毒性看,低级酯使细胞坏死几变性比高级酯大的多。从抗菌力看,低级酯比高级酯强的多,其聚合物也是如此。而从组织响应看,则又是低级酯比高级酯强些。因此在医疗应用上对这类粘合剂要想选择一种综合性能好的单体来聚合是困难的,到不如选择两种单体,例如甲酯用5%和庚酯用95%混合使用,可望得到好的效果。 此外,怎样协调这类粘合剂聚合和分解速率的相反结果,也是要考虑的。聚α-氰基丙烯酸低级酯所以在体内较易分解的主要原因是因为它的亲水性,因此,只要合成具有一定链长的亲水性α-氰基丙烯酸酯,就能把这对矛盾统一起来。如含有以下这些酯基的单体, 6.1.2 聚α-氰基丙烯酸酯的机械性能 这类粘合剂的抗张强度高,冲击强度较低,材料偏于脆性。但随着酯基碳链的增长,其抗张强度有明显降低,而冲击强度有所增高,材料的脆性则有所下降。 表6-1纤维蛋白原和氰基丙烯酸酯胶合软骨表面的强度[2]
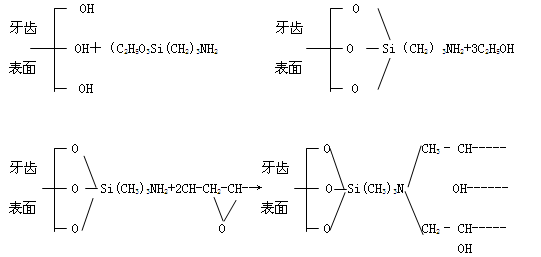
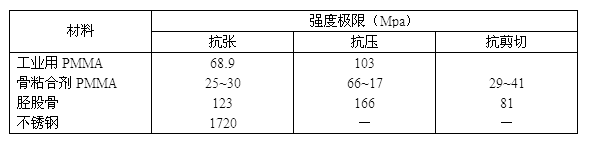
结果表明,在软骨对软骨和软骨对骨之间的粘合强度并没有显著的差别。纤维蛋白原粘合剂的剪切和抗张强度均明显地低于氰基丙烯酸酯的相应强度。虽然氰基丙烯酸酯的粘合作用明显优于纤维蛋白原,但是同纤维蛋白原相比,氰基丙烯酸酯的组织学性能表明它同软骨的相容较差。然而从生物力学的观点来看,剪切强度更为重要。纤维蛋白原如此低的剪切强度在体内是否适用,也可从压力和关节摩擦的数据计算出来。压力和摩擦系数的乘积就是滑移物的摩擦力。在正常的步行情况下,关节所受的压力约为350牛顿/厘米2,平均摩擦系数约为0.02,则在软骨表面上会产生约7牛顿/厘米2的剪切应力。可知在关节上所产生的剪切应力高于该粘合剂的软骨对软骨的粘接剪切强度(~5牛顿/厘米2)。所以纤维蛋白作为固定碎片骨折的粘合剂时其组织性能虽然较好,但是它的剪切强度则不够大。 6.1.3 α-氰基丙烯酸酯在医学上的应用 粘合剂用于粘合伤口时,直接将其涂在伤口上并不好,可以把组织的断裂处拉近,两边架上涤纶布片,再涂上粘合剂使它固定。实验表明,用于粘合血管时,乙酯型的粘合剂比甲酯型的要好得多。用于粘合皮肤时,其优点是不易产生疤痕。 6.1.4 其它医用粘合剂 一、 在脑动脉瘤表面补强,防止破裂方面的应用。 可在α-氰基丙烯酸甲酯中加入甲苯二异氰酸酯及丙烯睛合成橡胶混合,涂在瘤的表面。这种材料的成膜性、弹性和耐组织溶剂化物的性能均好;如用α-氰基丙烯酸乙酯代替其甲酯,可以改善甲酯的组织响应强的缺点。 二、在牙齿粘合方面的应用。 可用偶联剂在牙齿上联结,再把环氧树脂结合上去,可以免除用有毒的二元胺固化剂。其粘合过程为: 四、骨粘合剂(骨水泥)[3] 骨粘合剂是由粉状丙烯酸类聚合物(如甲基丙烯酸甲酯-苯乙烯共聚物)和其单体(如甲基丙烯酸甲酯)按一定配比搅拌混合,并在常温下由过氧化物引发剂引发,按自由基聚合在人体内部完成固化过程,从而达到使植入物固定于骨内。例如,人工髓关节的手术。由于这类医用树脂具有无毒、吸水率低、尺寸稳定及加工方便等优点,目前这种骨粘合剂仍被认为是较好的固定假肢的材料。对这种骨粘合剂在性能和改进方面的研究有以下一些进展。 1、 性能研究的进展 就上述骨粘合剂而言,实验证明,在聚合终止前,自由基浓度按一次幂衰减。自由基浓度在聚合起始变化不大,经过一段时间它达到极大值,而后逐渐衰减。衰减期可以延长到数天。在植入骨粘合剂的开始,周围组织中单体含量随时间增加而缓慢降低,经一定时间后,单体含量才开始迅速减少。由于单体的存在,吞噬细胞对葡萄球菌的吞噬功能降低。在骨粘合剂同骨组织界面间产生的松动除与粘合剂的机械性能有关外,还同聚合热效应及单体产生的毒性密切相关。在骨粘合剂中加进0.5~1克抗菌素,对聚合时的放热没有什么影响。由于骨粘合剂在体内受力情况的复杂性,只凭抗张,抗剪切,抗压等强度还不足表示它的使用寿命因此就要引进其它参数,如抗蠕变,耐疲劳极限及断裂韧度等,其中断裂韧度反映开裂增长时柔曲性能的变化,可用以表示材料抵抗开裂增长的能力。在显微镜下能显示出经过蠕变测试的样品内部都由于长期承受载荷而产生开裂。 骨粘合剂植入体内,在其周围发现先有中性细胞浸润,继而有微小血管、多核巨细胞及纤维组织。丙烯酸质点被巨噬细胞吞噬后经常形成环行状态,没有发生坏死。用骨粘合剂包裹截断的狗股骨,在70天和300天后观察其形态,发现骨质生长性依然很好。在置换人体或猫的髋关节时使用骨粘合剂,都发生了骤降血压,但是若静脉注射抑肽酶就能缓解这种效应。 2、 骨粘合剂的改进 对骨粘合剂的改进是针对提高它的机械性能、使用性能以及便于手术后的观察来进行的,现在简述如下: (1)不透x射线骨粘合剂 为了能在x射线下观察关节置换中的骨粘合剂。可以在骨粘合剂中加入BaSO4和ZrO2,它们的加入会影响骨粘合剂的力学性能,例如加入BaSO4时,骨粘合剂的抗开裂性能有所下降。在相同浓度下,加入BaSO4时,抗张强度的下降值为ZrO2的两倍,从而认为ZrO2比BaSO4较为优越。但也有人认为加入BaSO4后,有不会影响骨粘合剂流动性(即粘度)的优点。为了消除BaSO4对骨粘合剂的不良影响,可用含硅铝酸钡球状物替代,或者用表面活性剂丙烯酸酯和烷基硫醇等预先处理BaSO4。由于BaSO4来源易,成本低,所以仍然被使用。 (2)释放药物的骨粘合剂 为了要达到预防感染或进行某种治疗,而在骨粘合剂中预先加入抗菌素或其他药物。试验表明在40克骨粘合剂中加入0.4~0.5克药物不会影响骨粘合剂的机械性能,因此将骨粘合剂制成药物释放系统,则能使周围组织获得一定剂量的药物,而整个组织并不处于高浓度药剂状况,于是能达到高效低毒的疗效。加进骨粘合剂中的抗菌素在骨粘合剂中的存在要稳定,释放浓度要大以及持续期要长。但各种抗菌素在不同牌号骨粘合剂中的释放性能差别较大,国外对词已进行了大量工作。例如对抗菌素头孢甲氧霉素、先锋霉素、褐霉素、青霉素、庆大霉素和骨粘合剂Simplex-P,CMW和 Palacos等进行了试验。结果以庆大霉素在Palacos中的释放最高,即以G-P系统为最好。加入 银盐如AgCI,AgPO4和Ag2SO4等,对葡萄菌、希氏杆菌等有杀灭作用,其中以Ag2SO4持续期最长,且对骨粘合剂的机械性能无任何影响。 (3)填料增强的骨粘合剂 骨粘合刘在人体中所承受的负荷经常来自金属植入物,再由骨粘合剂传给骨骼。这三者的强度见下表: 表6.2 人骨,聚甲基丙烯酸甲酯(PMMA)及金属植入物的机械性能
由表中可见,由于骨粘合剂的机械强度小于人的骨骼,骨粘合手术的失败很可能是由于粘合剂的破坏造成的。因此要通过改变组份或其他物理方法来增强骨粘合剂的机械强度:在骨粘合剂中加入不锈钢丝,可用于脊椎成形术,钢丝直径为1毫米或0.5毫米。在截面中钢丝比例达1%时,骨粘合剂搞弯强度提高15%。亦可用玻璃陶瓷珠状物及长3毫米的玻璃纤维增强,这种骨粘合剂与组织的粘接良好,炎症反应微弱。以PMMA30%,下班珠状物60%,玻璃纤维10%,制成的骨粘合剂的抗压强度较大,再经液相介质浸泡,其抗冲击性能也有提高。使用碳纤维和玻璃纤维混合物增强,可改善骨粘合剂的抗压强度并产生各向异性的机械性能。碳纤维含量达10%时,抗压强度虽有所下降,但放热及其它机械性能会有所改善。长度1毫米的碳纤维含量达30%时,与普通骨粘合剂相比,其抗张强度能从25Mpa提高到38Mpa,同时抗蠕变性能得到改善,抗压缩蠕变和抗反复压缩蠕变将提高35%。同普通骨粘合剂相比,其耐疲劳极限由10 Mpa 下的10万次提高到15 Mpa下的10万次。随着耐疲劳能力增强,从而在应用中能保持较好的抗松动性能。将B2O3ZnO,CaO,及AI2O3等无机物融熔煅烧,冷后磨碎作为无机填料,加进这种铝硼化物的玻璃珠能够提高骨粘合剂的强度。加入AL(OH)3,CaCO3及Ca(PO4)2等无机物,可改善骨粘合剂的抗压强度。 (4)多孔性骨粘合剂 骨粘合剂中有孔隙存在,虽然造成强度上的缺陷,但有特定孔径的孔隙,则能使活体组织长入骨粘合剂的表层,形成一种“锚式”固定作用,从而提高人体骨同骨粘合剂的界面粘接强度,减少松动。这种骨粘合剂的制法是在骨粘合剂中掺入可溶性颗粒物质。如将磷酸三丁酯的骨粘合剂植入狒狒骨中,经4~14周,即观察到组织已长入孔隙中去。其它致孔剂有磷酸盐类、经甘油或乙醇处理的孔剂、蔗糖、CaCO3、Na2HPO4.12H2O等。以PMMA70%,CaCO320%,Na2HPO4.12H2O10% 并加少许H3PO4为起泡剂,可制成海绵状骨粘合剂,适合于软组织及硬组织长入。也有使用 H2O2,Ca3(PO4)2及聚乳酸或淀粉以及Ag3PO4等物质的。 (5)低粘度骨粘合剂 改善骨粘合剂的流动性,可使其迅速渗入组织或植入物的孔隙里,从而获得良好的固定作用。例如将直径25μ和150μ的珠状PMMA经研磨后的粉剂,加进1.8~2.2%高模量碳纤维,10%BaSO4 及1%H2O,混合后在20℃下,其粘度在6分钟后仍保持低于1500泊,在10~11分钟后则固化。 (6)水乳骨粘合剂 为改善骨粘合剂同金属植入物或骨骼间界面的粘固强度,可进行一种新粘固方法的尝试,在Co-Cr-Mo 及Ti-6AI-4V等金属植入物表面预涂骨粘合剂,然后粘接。把此试样与未预涂的参比样在37℃的生理盐水中浸泡30天后进行机械性能测试,发现预涂者的耐疲劳极限高出不预涂者几个数量级。将预涂骨粘合剂的股骨植入动物体内,分别在1、3、6个月后进行评价对比,发现预涂方法有突出优点。 (8)骨粘合剂组分改进 这里是改变化学组分以改善和提高骨粘合剂的某些性能促进剂的改进,近年来提出以三丁基硼或叔胺化物取代自凝胶系统骨粘合剂的催化剂N,N-二甲基苯胺 相关专题: |
||||||||||||||||

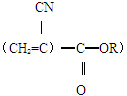 是较为人所熟知的,而凄然对它们也已研究得比较充分,这里只就有关的问题作一简要的介绍:
是较为人所熟知的,而凄然对它们也已研究得比较充分,这里只就有关的问题作一简要的介绍: